Какие заболевания развиваются в результате частого употребления алкоголя?
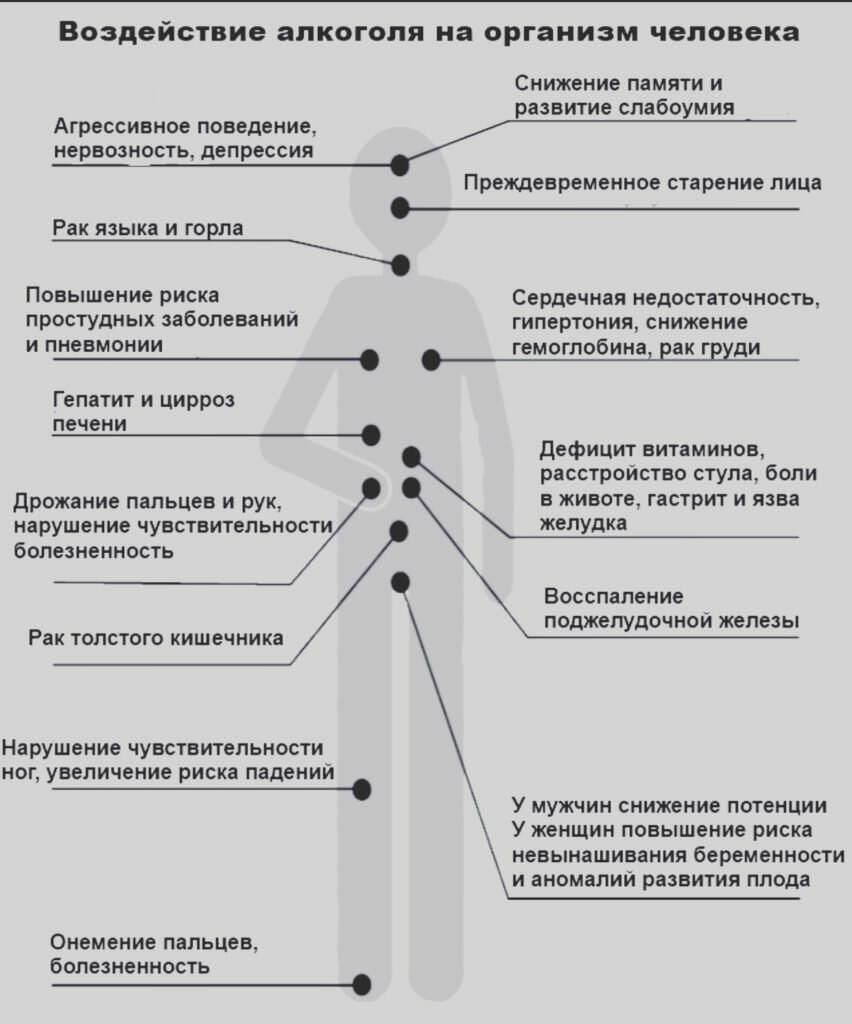
Какие заболевания развиваются в результате частого употребления алкоголя?
• Сердечно-сосудистые: повышение артериального давления, инфаркт миокарда и инсульт.
Алкоголь, попадая в организм человека, способствует повышению артериального давления. Чем больше человек пьет, тем выше поднимается его артериальное давление. Чем выше артериальное давление, тем больше нагрузка на кровеносные сосуды и сердце и тем выше риск развития сердечно-сосудистых заболеваний, инфаркта и инсульта.
• Болезни печени. Печень — орган, который выводит алкоголь из организма человека. Чем больше выпил, тем больше нагрузка на печень. Печень выводит из организма человека 10 мл чистого алкоголя за 1 час. Например, если кто-то выпил полбутылки вина, то через три часа после этого алкоголь все еще будет находиться у него в крови. Основными формами (этапами) развития алкогольного поражения печени выступают стеатоз, алкогольный гепатит и цирроз печени.
• Язвенная болезнь желудка и двенадцатиперстной кишки.
• Острый и хронический панкреатит (поражение поджелудочной железы).
• Рак губы и горла. Медицинские исследования доказывают: у людей, которые злоупотребляют алкоголем, может развиваться рак губы и горла. Риск значительно увеличивается, если тот, кто злоупотребляет алкоголем, еще и курит.
• Психологические проблемы и развитие депрессии. Многие из тех, кто регулярно злоупотребляет алкоголем, становятся нервными и раздражительными. Такое психологическое состояние отражается на их работе, на их отношениях с окружением и на их семье. Часто страдают дети. Если развивается депрессия, человек становится безразличным и теряет смысл жизни.
Призываем вести здоровый и трезвый образ жизни! Берегите себя и своих близких!

С 11 сентября в России начинается декада Дня трезвости.
Как и во всех регионах России , Министерством здравоохранения Республики Саха (Якутия) в сентябре объявлена Декада пропаганды трезвости. С 9 по 18 сентября 2021 года специалисты проведут огромный пласт работы.
Целью данного мероприятия является привлечение внимания населения к проблеме алкоголизма и пропаганда трезвого образа жизни.
Не секрет, что проблема алкоголизма имеет особую актуальность и несёт серьезную опасность как отдельно взятому человеку, так и современному обществу в целом. Алкоголь становится причиной несчастных случаев, отравлений, инвалидизации, разрушения семей, деградации личности, убийств и многих других негативных последствий. Считается, что алкоголь является причиной около 60 заболеваний.
В целях широкого освещения проблемы, информирования населения о пагубном влиянии алкоголя на здоровье и продолжительность жизни человека ГБУ РС (Я) «Олекминской ЦРБ» будут проведены различные мероприятия: лекции,выходы профилактических и просветительских статей, размещение видеоролика о пагубном влиянии алкоголя на организм. Для всех жителей и пациентов, в районой поликлинике будут розданы брошюры и буклеты , призывающие к Здоровому Образу Жизни. Также
в образовательных учреждениях будут проведены уроки ЗОЖ , посвящённые празднованию Всероссийского дня трезвости. Кроме этого, медики Олекминского района совместно с сотрудниками ДПС ГИБДД проведут информационно-просветительскую , профилактическую работу с участниками дорожного движения в целях профилактики дорожного травматизма, связанного с управлением транспортными средствами в состоянии алкогольного опьянения. Во время декады, медики Олекминского района проведут анкетирование среди пациентов по вопросам ЗОЖ; для лиц, страдающих алкогольной зависимостью и их родственников в наркологическом кабинете пройдут «Дни открытых дверей». Специалисты проведает прием и консультирование. Все вышеперечисленные мероприятия, проводимые в рамках Декады трезвости, направлены на снижение масштабов злоупотребления алкоголем среди населения.
#зож #noalcohol #алкогользло
Памятка для граждан, делающих выбор:лекарства или денежная компенсация
Памятка для граждан, делающих выбор:лекарства или денежная компенсация
Предоставление социальной помощи, в том числе получение лекарственных препаратов по льготным рецептам, гарантировано государством. Чрезвычайно важно сделать для себя правильный выбор формы такой помощи.
В тот момент, когда самочувствие человека не доставляет ему особого беспокойства, хронические заболевания не обостряются, не прогрессируют, ему легко поддаться соблазну заменить натуральные льготы денежным пособием. Как только состояние ухудшается, болезнь приобретает затяжной характер, требующий длительного лечения и множество лекарств, становится очевидным, что денежной компенсации недостаточно.
Если ранее Вами был сделан выбор в пользу денежной компенсации и Вы, как это нередко случается, убедились, что он был неправильным, Вам необходимо знать: восстановить право на получение набора социальных услуг возможно только после подачи соответствующего заявления в Пенсионный фонд. Министерство здравоохранения Республики Саха (Якутия) рекомендует Вам не позднее 1 октября текущего года подать заявление в Пенсионный фонд о возобновлении предоставления набора социальных услуг для получения бесплатной лекарственной помощи в 2022 году. После этой даты право на получение набора социальных услуг в течение календарного года возобновить будет невозможно (законодательством Российской Федерации это не предусмотрено).
Помните: от Вашего выбора зависит не только Ваше здоровье, но и здоровье, спокойствие и благополучие ваших родных и близких. Прежде чем принять решение, обязательно посоветуйтесь с лечащим врачом.
Для тех граждан, которые получают бесплатные лекарства в 2021 году, необходимости подачи заявления в Пенсионный фонд нет.
Памятка пациенту, сохранившему набор социальных услуг в части лекарственного обеспечения
Памятка пациенту, сохранившему набор социальных услуг в части лекарственного обеспечения
Обеспечение необходимыми лекарственными препаратами, медицинскими изделиями, а также специализированными продуктами лечебного питания для детей-инвалидов (далее — лекарственные препараты) по рецептам врача (фельдшера) осуществляется согласно ст. 6.2 Федерального закона от 17 июля 1999 года № 178-ФЗ «О государственной социальной помощи».
Порядок выписки льготных лекарственных препаратов:
Если Вы имеете право на обеспечение необходимыми лекарственными препаратами для выписки льготных препаратов, Вам необходимо обратиться в поликлинику по месту прикрепления.
При первом обращении при себе нужно иметь:
— документ, удостоверяющий личность (паспорт или иной документ);
— документ, подтверждающий право на получение набора социальных услуг (справка МСЭ);
— справку, выданную отделением Пенсионного Фонда Российской Федерации по Республике Саха (Якутия);
— полис обязательного медицинского страхования (ОМС).
При повторном обращении Вам понадобится только полис ОМС.
На период лечения в стационаре льготные рецепты не выписываются.
Выписка льготных рецептов на лекарственные препараты осуществляется по медицинским показаниям, определяемым лечащим врачом.
Перечни лекарственных препаратов для медицинского применения, медицинских изделий, отпускаемых по рецептам на медицинские изделия, а также специализированных продуктов лечебного питания для детей-инвалидов утверждаютсяраспоряжениями Правительства Российской Федерации.
Порядок получения льготных лекарственных препаратов:
Лекарственный препарат, выписанный по льготному рецепту, можно получить в пункте отпуска лекарственных препаратов, участвующих в программе льготного лекарственного обеспечения.
Информация о сроке действия рецепта, а также о местонахождении пункта отпуска льготных лекарственных препаратов, прикрепленных для обеспечения к поликлинике, предоставляется пациенту лечащим врачом, осуществляющим назначение льготного лекарственного препарата.
Срок действия рецепта:
Рецепты на лекарственные препараты, выписанные бесплатно, действительны в течение 15-90 дней со дня выписывания.
Рецепты на лекарственные препараты, выписанные гражданам, достигшим пенсионного возраста, инвалидам первой группы, детям-инвалидам, а также гражданам, страдающим хроническими заболеваниями, требующими длительного курсового лечения, действительны в течение 90 дней со дня выписывания.
Для лечения хронических заболеваний указанным категориям граждан рецепты на лекарственные препараты могут выписываться на курс лечения до 180 дней.
По истечению срока действия, рецепт в аптеке не принимается.
Как получить право на обеспечение необходимыми лекарственными препаратами:
Набор социальных услуг включает в себя следующие социальные услуги:
— обеспечение необходимыми лекарственными препаратами,
— санаторно-курортное лечение,
— проезд на железнодорожном транспорте.
Отказаться или вернуть право на социальный пакет или на одну из указанных услуг можно один раз в год до 1 октября, при этом право возникает с 1 января следующего года.
Обращаем Ваше внимание, что сохранение права на обеспечение необходимыми лекарственными препаратами позволит пациентам получить необходимую лекарственную помощь, в том числе и обеспечение дорогостоящими лекарственными средствами, что в свою очередь защитит пациентов от дополнительных расходов на лекарственные препараты, затраты на которые могут не соответствовать доходам гражданина.
Памятка для населения по профилактике осложнений после перенесенной новой коронавирусной инфекции
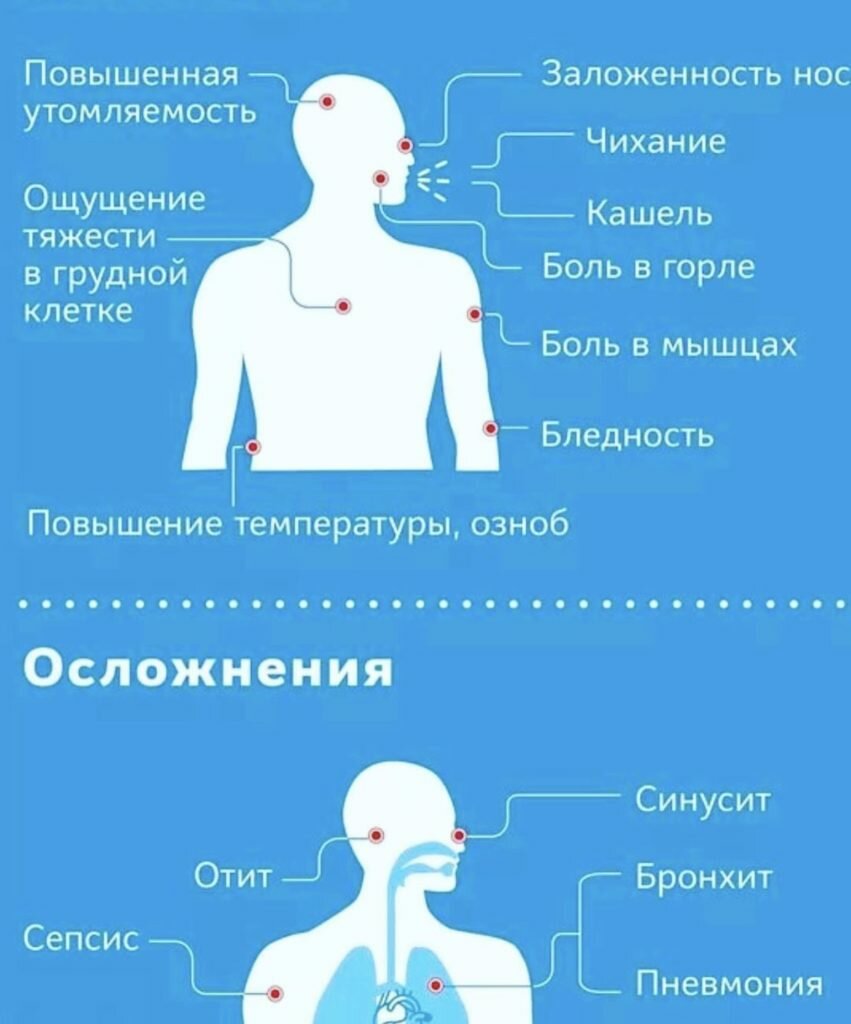
Памятка для населения по профилактике осложнений после перенесенной новой коронавирусной инфекции➢
Какие могут быть последствия перенесенной новой коронавирусной инфекции?
Одним из вариантов последствий COVID-19 является постковидный синдром. Это стойкие симптомы и/или отсроченные или долгосрочные осложнения по истечении 4 недель с момента появления симптомов.
Изучение данного синдрома показало, что лица, переболевшие COVID-19, имеют симптомы, которые могут в последствии вызывать осложнения и отклонения в деятельности различных систем органов.
Ниже представлена частота развития наиболее серьезных осложнений после перенесенной новой коронавирусной инфекции: ✓ тромбозы 20-30% одышка 31,7% кашель 13,5%, жалобы на боль в груди и тахикардию 12,7% и др.
Эти симптомы в первую очередь могут говорить о нарушении в деятельности сердечно-сосудистой и дыхательной систем. Есть и другие симптомы, проявление которых встречается в меньшей степени, однако и они способны вызывать неблагоприятные последствия у человека, перенесшего новую коронавирусную инфекцию.➢ Как это можно предотвратить?
Важно своевременно выявить изменения после перенесенной инфекции и предотвратить развитие осложнений.➢ Что необходимо сделать?
С 1 июля 2021 года на территории России с учетом эпидемиологической обстановки стартовала углубленная диспансеризация.
Данное мероприятие направлено на своевременное выявление осложнений и предупреждения их прогрессирование после перенесенной новой коронавирусной инфекции.
Пройти углубленную диспансеризацию можно в поликлинике по месту прикрепления. При себе необходимо иметь паспорт и полис.➢ Что входит в углубленную диспансеризацию?
Методы исследования, которые позволяют своевременно выявить изменения в деятельности различных систем органов, а также возможные осложнения после перенесенной новой коронавирусной инфекции.
Мероприятия первого этапа проводятся всем пациентам, пришедшим на углубленную диспансеризацию. Объем исследований второго этапа зависит от результатовпервого.➢ I этап включает:✓ анкетирование, вопросы которого позволяют врачу понять основные жалобы пациента;✓ измерение насыщения крови кислородом (сатурация) позволяет выявить отклонения в деятельности дыхательной системы;✓ тест с 6-минутной ходьбой проводится по показаниям и направлен на исследование сердечно-сосудистой системы;✓ спирометрия проводится для оценки деятельности дыхательной системы;✓ рентгенография органов грудной клетки проводится лицам, не проходившим раннее в течение года данное исследование, и также направлено на оценку дыхательной системы;✓ определение концентрации Д-димера в крови проводится только лицам, перенесшим коронавирусную инфекцию средней степени тяжести и выше и позволяет выявить риск развития тромбозов;✓ общий клинический анализ крови (развернутый) помогает понять причину таких симптомов как, например, высокая утомляемость;✓ биохимический анализ крови включает в себя исследование 7 показателей и также позволяет сделать вывод о причинах развития высокой утомляемости, нарушении функционирования сердечно-сосудистой, пищеварительной систем.
По результатам исследований первого этапа углубленной диспансеризации проводится прием (осмотр) врачом-терапевтом, который может направить пациента на дальнейшие исследования в рамках II этапа.➢ Исследования II этапа помогают с большей вероятностью определить нарушения в деятельности определенной системы органов и помочь предотвратить развивающиеся осложнения.✓ Нарушения деятельности сердца и сосудов помогает выявить эхокардиография;✓ Проведение дуплексного сканирования вен нижних конечностей (УЗИ) позволяет определить наличие тромбозов;✓ КТ органов грудной клетки направлено на исследование легких и дыхательной системы в целом.➢ Могу ли я пройти углубленную диспансеризацию, если я уже проходил диспансеризацию/профилактический медицинский осмотр в этом году?➢ Да. Углубленная диспансеризация является самостоятельным мероприятием и не связана с проведение диспансеризации или профилактического медицинского осмотра.
Памятка для проведения разъяснительной кампании о правилах
безопасного поведения при аномальной жаре➢ Жаркая погода особенно опасна для детей и лиц, имеющих хронические заболевания.➢ Пребывание на солнце людей со злокачественными новообразованиями усугубляет течение заболевания и негативно влияет на состояние их здоровья. Также опасна жара для граждан с болезнями сердечно-сосудистойсистемы, так как возможно развитие тромбозов, нарушения сердечного ритма, ишемической болезни сердца, сердечной недостаточности и хронической венозной недостаточности.➢ Также в жару можно легко получить воспалительные заболевания, особенно ангины и пневмонии. Чрезмерное охлаждение тела и пребывание в мокрой одежде под вентиляторами и кондиционерами могут ослабить иммунитет и привести к простудам и инфекционным заболеваниям.➢ Во время жаркой погоды у людей снижается концентрация внимания и из-за этого возникают проблемы в выполнении сложных производственных заданий. Они могут становиться более раздражительными и испытывать головные боли.➢ Работающим гражданам, как в офисах, так и дома на удалёнке, в жару необходимо строго соблюдать питьевой режим. Не забывайте пить больше жидкости и делайте это регулярно. Лучше всего подходит обычная вода и морсы. Сладкие напитки будут лишь усиливать жажду. Категорически не рекомендуется употреблять в жару алкоголь, ведь он нарушает процессы терморегуляции.➢ Отдавайте предпочтение теплой пище, избегайте приема жирной и тяжелой пищи. Есть рекомендуется небольшими порциями.➢ Если человек вынужден работать на жаре, то нужно пить каждые 15 минут и увеличить количество перерывов в работе. Идеально чередовать работу на жаре с пребыванием в прохладном кондиционируемом помещении.➢ Во время жары особенно рекомендуется отказаться от курения сигарет, вейпов, кальянов и использования других средств доставки никотина.➢ Не игнорируйте первые признаки перегрева и обезвоживания: ✓ сухость во рту, нарастающая жажда, слабость, головная боль, учащенное сердцебиение, головокружение при вставании, вплоть до потери сознания.➢ При возникновении данных признаков необходимо в первую очередь переместить пострадавшего в тень, дать выпить прохладную воду, освободить от сковывающей одежды, чтобы дать больший приток кислорода при дыхании. В случае, если человек потерял сознание, необходимо вызвать скорую помощь.